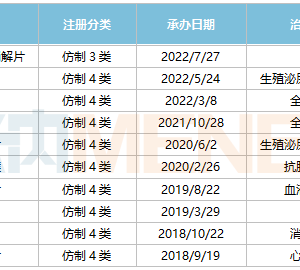
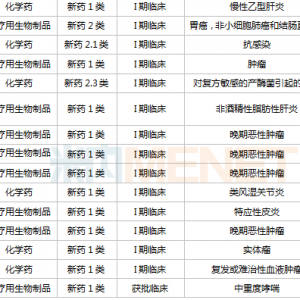
编译丨范东东
日前,在对其血小板增多症药物Anagrelide进行常规稳定性测试时,梯瓦(Teva)发现该药物存在溶解不良的问题。由于药物溶解测试失败,患者服用该药物后需要更长的时间才能溶解,为此梯瓦正在美国市场召回一批0.5毫克剂量的Anagrelide胶囊,其他批次暂时没有受到影响。
梯瓦在美国FDA网站上的通知中警告称,服用不能正常溶解的Anagrelide胶囊,将会抑制或抵消药物减少血小板的作用。溶解不良的胶囊会妨碍药物的有效性,甚至导致治疗无效,而对于患有严重的血液疾病患者来说,服用这些有问题的Anagrelide胶囊可能会产生致命影响。
截至本周一,梯瓦表示尚未收到任何可疑批次的质量投诉或副作用报告。在2020年7月30日至9月2日期间,该公司在美国市场共计铺货4224瓶,有问题批次的Anagrelide胶囊有效期将于本月到期。
此前,Anagrelide胶囊已获得美国FDA批准,用于治疗继发于骨髓增生性肿瘤的血小板增多症。具体来说,血小板增多症患者的身体会产生过多的血小板,造成出血、凝血异常,进而导致患者面临心脏病发作或中风的风险。
梯瓦解释称,旨在减少血小板计数的Anagrelide胶囊如果存在不良溶解的情况,可能会促使药物释放的速度和程度变慢,导致患者体内可用的Anagrelide成分减少,患者就很难避免发生凝血、出血或凝血和出血事件。
值得注意的是,这并不是梯瓦今年首次出现在美国FDA的召回记录中。早在今年3月,该公司表示因在内部检查时发现瓶装药物中含有二氧化硅和氧化铁颗粒物质,随后该公司表示将召回一批可注射的白血病药物IDA rubicinhydrochloride。
患者如果注射了受杂质颗粒污染的药物,可能会导致轻微的副作用,例如局部刺激或肿胀,但如果颗粒物质到达血管,这些杂质会随血液循环到人体各个器官,并患者阻塞心脏、肺或大脑的血管,导致患者中风甚至死亡。不过,该公司在3月下旬指出,根据内部健康评估确定患者受到伤害的可能性很小。
除此之外,行业组织预测由于梯瓦位于加利福尼亚州欧文市的制造工厂长期陷入困境,可能会导致多达24种非专利无菌注射药物的短缺。最终药物短缺联盟(EDSA)最近得出结论,该工厂生产的用于治疗癌症、成人和儿童糖尿病以及胰腺神经内分泌肿瘤的药物将出现短缺的情况。
EDSA表示,最容易出现短缺的可能是血管扩张剂前列地尔、抗生素阿米卡星和化疗药物博来霉素、达卡巴嗪、伊达比星、异环磷酰胺、米托蒽醌、链脲佐菌素和拓扑替康,以及激素奥曲肽用于治疗肠道肿瘤的症状。不太可能面临短缺的其他注射剂是腺苷、柔红霉素、去氨加压素、依前列醇等。
EDSA敦促制药商应及时考虑是否需要增加生产受影响的药物,同时建议批发商储存足够的供应品,以确保药物充足可用。此外,EDSA还呼吁美国FDA应加快批准所有受工厂关闭影响的药物申请,或允许进口这些药物,特别是某些没有替代药物的情况(例如用于治疗胰腺癌的链脲佐菌素)。
去年7月,美国FDA在检查中发现该公司没有修复工地的水源破坏,也没有遵守工厂工人传播霉菌和细菌的预防程序,梯瓦也未能确保无菌和有害生物测试设备的正常工作。梯瓦为了回应美国FDA对该工厂存在污染问题的担忧,不得不最终停止了工厂的运营。污染问题已经导致该公司今年早些时候被迫召回了250万瓶用于治疗癌症、关节炎、精神分裂症和肌肉松弛剂等药物。
参考来源:
1、Teva recalls one lot of blood disorder med after testing flags capsule woes
2、Teva’s halt at troubled plant threatens to create shortages in wide range of injectable meds: report
本网页由机器采集生成,若侵权请及时联系删除。
原文链接:https://med.sina.com/article_detail_100_2_117191.html