编译丨范东东
勃林格殷格翰周五表示,Cyltezo已获得美国食品和药品监督管理局(FDA)的批准,该药物也成为第一个可互换的Humira生物类似药。
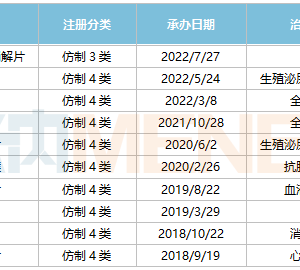
目前,即便许多生物类似药公司已经与Humira制造商艾伯维选择达成专利和解协议,但勃林格殷格翰(Boehringer)似乎仍坚持挑战艾伯维的市场地位。根据该公司与艾伯维的专利和解协议,勃林格殷格翰必需直到2023年7月1日才能推出Humira仿制药,但此次Cyltezo获得监管批准将意味着药剂师可以在药房柜台用Cyltezo代替Humira。
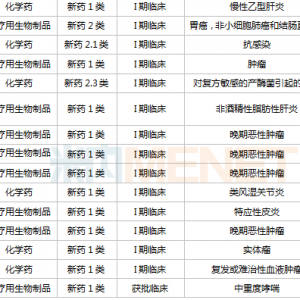
到目前为止,每个获批的生物类似药都需要专门针对该生物类似药本身的处方。可互换性意味着生物类似药可以被视为小分子仿制药,Cyltezo可以随意替代其参考品牌原研药Humira。因此,伯恩斯坦分析师Ronny Gal周一向客户指出,批准不仅对Humira生物类似药市场很重要。
Cyltezo获得批准对于整个领域来说也是“里程碑式的成就”,因为该疗法是第一个可互换的单克隆抗体,而且大多数生物类似药靶向的药物都是单克隆抗体或mAb。该消息显示FDA现在已经制定了可互换药物批准的要求。Gal补充说,“此举将促进其他同类药物未来获得批准,同时我们也应该密切关注,从长远来看可互换的生物类似药是否将成为mAb药物的唯一生物类似药。”
同时,针对Humira市场,Gal表示勃林格殷格翰“不应被低估”,因为该公司具有“重要的生物制造和美国市场的商业能力”。在美国,勃林格殷格翰在加利福尼亚州弗里蒙特拥有数千名员工和制造工厂。此外,该公司还刚刚在奥地利开设了一个大型生产基地。
不过,勃林格殷格翰不会是唯一一个与Humira争取丰厚市场利润的公司。根据2017年的交易,安进将在2023年1月31日推出首个Humira生物类似药。默沙东和合作伙伴三星Bioepis则通过谈判获得了一项从2023年6月30日开始的许可。
艾伯维的重磅炸弹Humira去年在美国市场产生了超过160亿美元的收入。但反对者仍打算在法庭上挑战艾伯维的专利,冰岛Alvotech此前对艾伯维(AbbVie)提起诉讼,预计将在明年10月底之前对该案做出裁决。Alvotech也在寻求可互换仿制药获得批准,并已成功地为其候选药物完成了转换研究。
参考来源:Boehringer’s interchangeable tag for Humira biosim is a ‘landmark’ win for the field: analyst
本网页由机器采集生成,若侵权请及时联系删除。
原文链接:https://med.sina.com/article_detail_100_2_107233.html