12月26日,阿斯利康宣布,已与亘喜生物(Gracell Biotechnology)达成协议,以约12亿美元的总价格收购后者。收购完成后,亘喜生物将作为阿斯利康的全资子公司,在中国和美国开展业务。

根据最终协议条款,阿斯利康将合并收购亘喜生物的所有稀释后股份(包括所有ADS代表的股份)。阿斯利康公司将在交易结束时,以公司普通股(“普通股”)每股现金价格2.00美元(相当于每股ADS10.00美元)完成收购。此外,条款中还附加了一项不可交易的或有价值权益,阿斯利康公司将在达到特定监管相关里程碑时,支付普通股每股现金价格0.3美元(相当每股ADS1.5美元)。出价的首付现金部分代表的交易价值约为10亿美元,较之亘喜生物在2023年12月22日的收盘价溢价62%,比公告发布前60天成交量加权平均价格(VWAP)每股ADS3.94美元溢价154%。
如果这笔首付款以及潜在的或有价值付款达成的话,合计交易价值约为12亿美元,较之亘喜生物在2023年12月22日的收盘价溢价86%,比60天的VWAP溢价192%。
作为拟议交易的一部分,阿斯利康公司将获得亘喜生物资产负债表上剩余的现金、现金等价物及短期投资。截至2023年9月30日,亘喜生物资产负债表上的现金和有价证券总额为2.34亿美元。该项交易预计于2024年*季度完成。
消息传出后,亘喜生物美股涨8.38%。更有此前亘喜生物Q3财报,净亏损大幅收缩至6760万元,研发支出减少约32.5%。
目标核心管线:
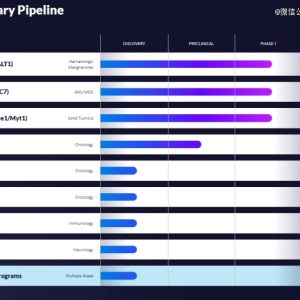
GC012F CAR-T细胞疗法
此次拟议收购将为阿斯利康公司不断扩充的细胞疗法管线增添GC012F CAR-T细胞疗法。
作为基于FasTCAR技术平台打造的核心产品,GC012F是一款处于临床阶段的创新型BCMA/CD19双靶点自体嵌合抗原受体T(CAR-T)细胞疗法,有望成为针对多发性骨髓瘤、其他各类恶性血液肿瘤以及自身免疫性疾病(包括系统性红斑狼疮(SLE))的新一代治疗方案。
GC012F为一款靶向BCMA/CD19的 CAR-T疗法。根据日前亘喜生物在第65届美国血液学会(ASH)年会上以口头报告,截至2023年10月1日,22例可评估患者中位随访时间18.8个月,疗效方面:ORR依旧高达100%,sCR率也高达95.5%,MRD- 率同样保持了100%,中位DOR和中位PFS数据尚未成熟。安全性方面,GC012F延续了一贯的*表现。仅27%(6/22)的患者出现细胞因子释放综合征(CRS),且均为低级别,包括1级(23%,5/22)和2级(5%,1/22)。未观察到患者出现任何级别的ICANS或其他神经毒性。
目前,GC012F治疗难治性系统性红斑狼疮的1/2期临床试验申请获得FDA批准。12月21日,GC012F注射液在中国获批临床,拟开发治疗难治性系统性红斑狼疮(SLE)。
值得一提的是,GC012F结合了开创性的CD19/BCMA双靶点设计和突破性的FasTCAR次日生产技术。自体CAR-T细胞疗法的原理是通过重新编辑修饰患者自身的免疫性T细胞,使之靶向攻击致病性细胞以治疗疾病。生产制备过程复杂且冗长是当下细胞疗法行业面临的主要瓶颈。由此,亘喜生物开创性的开发了FasTCAR次日生产技术平台,不但能能显著缩短生产时间,还能强化T细胞健康状态,进而提高自体CAR-T疗法针对患者的潜在有效性。该技术亦有未来应用于治疗罕见病的潜力。
亘喜生物:自建三大技术平台,两条管线进入临床
成立六年的亘喜生物是继南京传奇、药明巨诺、永泰生物之后第四家登陆资本市场的中国细胞疗法公司。
针对目前CAR-T细胞疗法的行业挑战,亘喜生物建立了自有的三大技术平台,包括FasTCAR次日生产技术平台、TruCAR和SMART CART。
ruCAR是亘喜生物具有知识产权的技术平台,旨在开发高质量的“即用型”同种异体CAR-T细胞疗法,进一步降低成本的同时,提供更好的便利性。TruUCAR通过基因编辑实现差异化设计,可在无需与免疫抑制性药物联用的情况下,分别控制宿主抗移植物排斥反应(HvG)和移植物抗宿主病(GvHD)。TruUCAR 创新的双CAR设计,能使针对肿瘤抗原的CAR杀伤肿瘤细胞,而针对CD7的CAR抑制宿主抗移植物反应,使TruUCAR T细胞得以成为一款单药使用的“即用型”同种异体CAR-T疗法。
SMART CART是公司的第二代增强型CAR-T技术模块,针对性攻克实体瘤治疗的重重挑战,包括免疫抑制性肿瘤微环境(TME)负面影响T细胞激活及存活、实体肿瘤异质性,以及难以渗透到肿瘤内部。在临床前研究中,SMART CAR已经初步呈现出多项独特优势,包括更*的扩增能力、持久性以及肿瘤杀伤效果。
基于三大技术平台,亘喜生物正在打造一条包含多种自体和同种异体候选产品的丰富临床阶段产品管线,并有望与行业当前的CAR-T细胞疗法形成显著差异化。

GC007g是亘喜生物*个获得临床批准的创新产品,该产品是一种供者来源靶向CD19 的嵌合抗原受体CAR-T细胞产品,治疗复发难治B急性淋巴细胞白血病。该治疗采集干细胞移植供体的健康T细胞,通过慢病毒转导制备靶向CD19肿瘤细胞,针对经异基因骨髓移植后复发的B急性淋巴细胞白血病患者。与使用患者自身的T细胞相比,这种策略下的T细胞状态更好(T cell fitness),预期产生的疗效更佳。复发难治B淋巴细胞白血病患者,他们可能因感染原因导致无法提供合规的细胞,或自体CAR-T细胞生产不成功,或未能从自体CAR-T治疗中临床获益,对于这部分病人,GC007g可能是替代方案。供者来源CAR-T产品另一优势是可提前生产,避免患者等待而导致疾病进展。
自中国Biotech有史以来,亘喜生物是*个被MNC完整收购的中国创新药企。
【本文由投资界合作伙伴动脉网授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。
本网页由机器采集生成,若侵权请及时联系删除。
原文链接:https://news.pedaily.cn/202312/527655.shtml