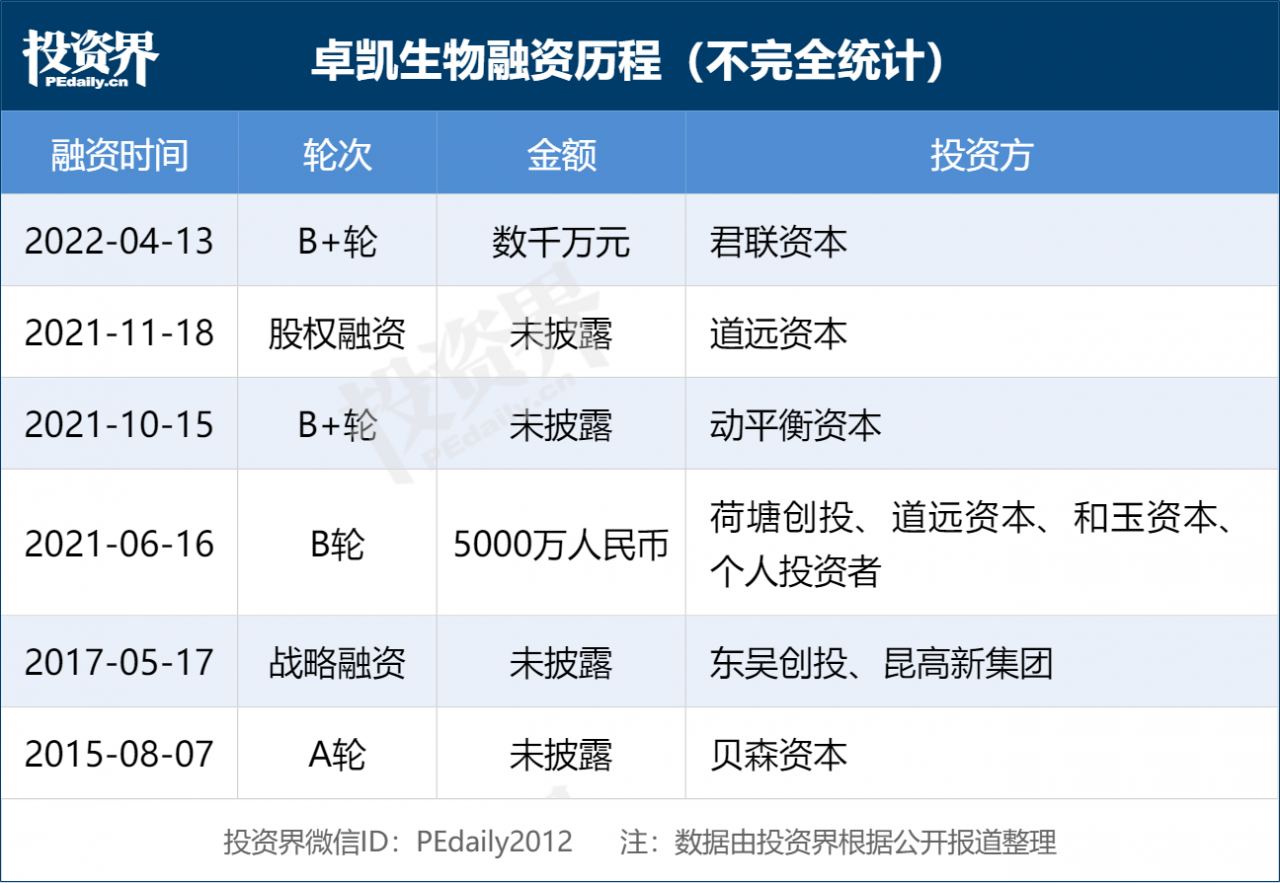
投资界(ID:pedaily2012)4月13日消息,神经和精神类疾病药物研发商卓凯生物宣布完成数千万元B+轮融资,本轮融资由君联资本独家投资,此前公司已完成由荷塘基金领投,道远资本、和玉资本(MSA capital)、动平衡等机构跟投的B轮融资。
北京卓凯生物技术有限公司(JoeKai Biotech_Beijing)成立于2001年,由美国冷泉港著名脑神经学习记忆专家,清华大学医学院教授钟毅博士成立组建。公司旨在开发精神类疾病果蝇模式动物及相关药物的开发。目前,公司拥有1200平米实验区,包含果蝇嗅觉学习记忆评价平台,SPF级转基因小鼠实验平台。公司拥有多项国内、国际药物开发和生物技术的专利。当前公司主攻方向是阿尔兹海默症和孤独症的药物评价和开发。
从减少Aβ沉积、Tau蛋白聚集,到改善神经炎症表现、减少微血管形成障碍、增强神经元功能,科学界在阿尔茨海默症(AD)的治疗靶点上进行了诸多尝试。21世纪以来,虽然数十项临床试验在II/III期失败,但仍然有二十余项药物正在开展III期临床试验。如何克服现有AD药物传统开发路径中所遇到的困难,成为解决AD这一未被满足的临床需要的重要难关。
清华大学生命科学学院钟毅教授课题组,为了解决AD疾病机制复杂,传统靶点和疾病症状距离较远、药效也较差的问题,建立了果蝇表型筛选平台,以表型筛选的方式探索AD疾病的治疗范式。基于该平台,钟毅教授于2010年首次发现了影响记忆的“主动遗忘生物机制”,并将其研究成果发表在了知名学术期刊《Cell》上。随着领域内对该机制研究的不断深入,与钟毅教授带领团队的不断努力,使得“主动遗忘生物机制”成为了治疗阿尔茨海默症的潜在新路径。
钟毅教授是神经生物学领域的知名专家,现任清华大学生命科学院教授,曾为清华麦戈文脑科学研究院首任院长。1992年,钟毅在博士毕业时就破格受聘在美国冷泉港实验室神经生物学系任教并领导独立的实验室,并于2004年晋升为美国冷泉港实验室教授。钟毅教授在神经生物学领域有着30余年的研发经验,利用领先的果蝇表型筛选平台和后续的小鼠验证,在疾病机制复杂的诸多神经与精神系统疾病,如老年痴呆症、自闭症、精神分裂症和抑郁症等领域发表了数十篇高水平论文,并主导了主动遗忘机制的发现和研究。
生物的主动遗忘机制是指,学习过程本身会激活遗忘信号分子通路,进而主动地遗忘所形成的记忆。这种主动遗忘机制并不影响学习自身效果的好坏,而是特异地影响已获得记忆遗忘速度的快慢。
为了研究大脑的主动遗忘理论,钟毅教授团队以果蝇和小鼠作为实验对象,对记忆主动遗忘的分子机制进行了系统地比较和解析。根据钟毅教授团队的研究成果,不同记忆组分会分别拥有专属的主动遗忘机制,在果蝇模型中,Rac1/WAVE complex/Dia通路介导短期记忆组分(不稳定的、维持几个小时的记忆)的主动遗忘,而Cdc42/WASp/Arp2/3 complex通路介导长期记忆组分(维持一天以上的记忆)的主动遗忘。
由诺贝尔奖得主MIT的Tonegawa教授提出的记忆痕迹细胞理论认为记忆在大脑中的编码可存储于不同状态,即正常学习产生的记忆存储于通过自然回忆可提取的潜伏态,而人工干预或病理状态下(如阿尔茨海默症患者)学习产生的记忆编码则可能存储于不可提取的静默态。钟毅教授团队的研究揭示了存在多种存储状态的生理学意义和编码状态之间转换的机制,即负向情绪激活Rac1主动遗忘机制使正常记忆静默化而无法提取,正向情绪则抑制Rac1以使静默化的记忆变成潜伏态而重现记忆 (下图)。这个发现为重现阿尔茨海默症患者失去的记忆开拓了全新思路。
阿尔茨海默症患者Rac1蛋白的过度激活导致了遗忘的过度活跃,即静默化记忆,表现为记忆的快速丢失。抑制Rac1蛋白在AD患者中的过度激活有望解决AD患者的遗忘异常,进而挽救记忆损伤。同时,由于Rac1是重要的突触蛋白,维持其活性的正常有助于增强神经元自身的功能,降低有毒的Abeta水平、抑制tau蛋白的过度磷酸化并降低炎症水平。由此,主动遗忘蛋白Rac1成为治疗阿兹海默症的最新靶点。特异性地抑制脑部海马区的Rac1蛋白,有望改善患者记忆,进而起到治疗阿兹海默症的目的。
从AD到自闭症,全球首个Rac1靶向药进入临床研究
为了探索这一创新机制能否改变AD治疗药物的发展方向,钟毅教授组建了北京卓凯生物技术有限公司(简称:卓凯生物),围绕Rac1靶点进行新药开发。Rac1蛋白是一个难成药的靶点,一方面其作为Ras超蛋白家族成员,结构具有不可成药性,另一方面Rac1蛋白在全身各组织中均发挥重要功能,而阿尔兹海默症的治疗需要特异地在大脑中调控Rac1活性。
“针对大脑记忆和遗忘的疗法和其他疗法不同,记忆需要极速地响应,如果依旧通过控制蛋白含量去调控相关功能,这样大脑的反应速度太慢。”卓凯生物总经理马伟伟介绍,“在我们大脑里,实际上Rac1蛋白主要是通过‘磷酸化开关’实现快速响应,磷酸化后就有活性,去磷酸化就无活性,从而实现大脑的快速响应。”这也解释了为什么无法直接开发降解剂调控Rac1蛋白活性。
卓凯生物使用其核心竞争优势,即基于果蝇的表型筛选技术平台,通过高通量的表型筛选手段,以结果为导向,精准地获得对Rac1靶点有较好抑制性的候选分子。
功夫不负有心人,卓凯生物在2017年完成了靶向Rac1的分子筛选,并由具有丰富药物化学改造经验的公司联合创始人汪舰教授进行改造。,建立了JK-50561研发管线。动物模型的研究结果显示,JK-50561除了对多种AD动物模型发挥作用外,对血管痴呆、衰老等其他动物模型也展现出良好的记忆改善表现,通过多种动物模型的交叉验证,进一步验证了Rac1的机理与50561的药理作用。该管线在2021年3月获得中国CDE的IND默示许可,9月完成首例入组。目前50561的临床Ia期试验接近完成,其结果表现出良好的药代动力学(PK)特征和极高的安全性。JK-50561是全球首个从遗忘角度治疗阿尔茨海默症的新药(first in concept),预计在2022年下半年进入二期临床试验阶段。
与此同时,公司也充分利用从表型筛选技术平台到临床药物转化开发的丰富经验,形成了一套独特的药物研发平台,在其他CNS疾病领域开展布局。
在自闭症领域,我们常见的自闭症动物模型因为不能正常激活Rac1,而无法启动主动遗忘机制,使得社会交往、认知灵活性等受损。在自闭症管线的推进上,卓凯生物目前正在进行临床前研究,取得了令人兴奋的进展,预计2022年底开启研究者发起的临床研究。
此外,公司在运动神经元退行疾病领域也在积极推动渐冻症的1.1类新药,同事也同步推进了治疗抑郁症的新疗法等,预计2年内进入临床申报阶段。
随着产品研发推进,卓凯生物在2016年完成由中山贝森资本投资的首轮融资后,在2021年中完成了由荷塘基金领投,道远资本、和玉资本(MSA capital)和动平衡等机构跟投,总额数千万元人民币的B轮融资;在2021年底又完成了由君联资本独家投资的B+轮融资。。
本文来源投资界,原文:https://news.pedaily.cn/202204/490061.shtml
原文链接:https://news.pedaily.cn/202204/490061.shtml