全球疫情升级下,医疗与生命科技行业再次成为市场关注的焦点。对于这一长期关注并深耕的重要领域,华兴医疗团队在这个乍暖还寒的早春依然延续惯例,从生物医药、IVD及基因检测、医疗器械到医疗服务、智慧医疗五大领域及资金端入手,力求全面描摹过去一年间全球医疗领域发展风向。
2019年中国诊断及基因检测行业的融资环境进一步趋紧,私募融资领域头部效应显著,基因检测类公司在交易数量及融资金额上均名列前茅;科创板开板半年来,IVD成为生物医药板块中的热门细分领域;并购市场全年共成交两笔超过10亿人民币的重大交易。海外市场的融资交易超过半数由基因检测企业完成,与此同时分子诊断公司热度持续,占据大量行业资源。
本期报告将围绕国内和国际两个市场,分别盘点2019年诊断及基因检测行业各细分领域的资本动作。

2019年中国诊断及基因检测行业的融资环境进一步趋紧。过去一年,中美贸易争端的持续拉锯以及美国限制对华技术转移,坚定了国家加大力度扶持高端医疗器械行业的信念,各级政府的政策也更加鼓励行业加大自主创新的力度。
目前多地地方政府已经出台了允许采购进口医疗设备和试剂耗材的清单。我们预计新冠疫情后,生物安全领域的高端国产设备将更受关注,我国医疗装备在自主可控的道路上将更进一步。
然而,诊断行业受医保控费方面的潜在影响不可忽视:部分省市开始实施体外诊断试剂的“两票制“和带量采购;终端医疗机构采取”以量换价“模式成为趋势;IVD厂商和经销商都将面临考验。

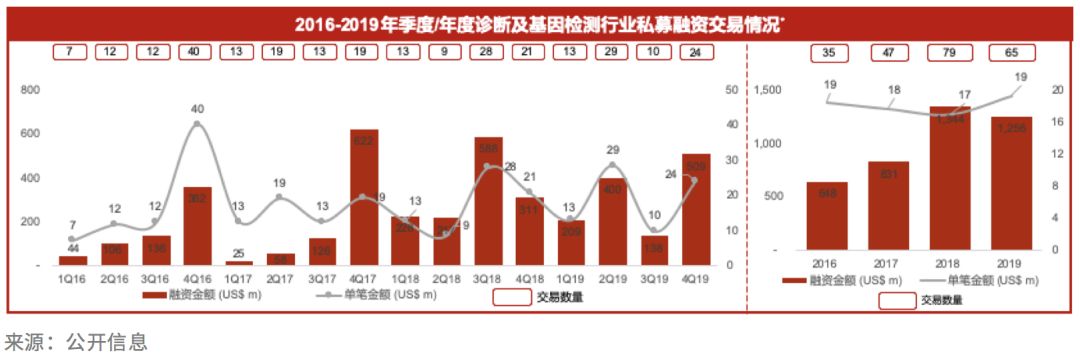
据统计,2019年我国诊断及基因检测行业共发生私募融资交易65起,同比2018年下降约18%,但总融资金额与2018年相比仅略有下降,为约12.5亿美元。

过去一年,行业私募融资领域的头部效应非常明显。仅3笔单笔融资金额大于1亿美元交易的总金额,就占据了年度交易总额的1/3。这3笔头部交易分别是华大智造2亿美元的A轮、燃石医学1.3亿美元的C轮以及世和基因1.1亿美元的D轮融资。
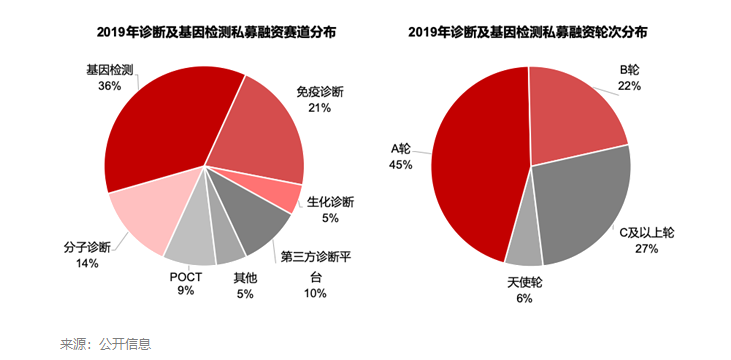
细分赛道中,基因检测类公司首屈一指,交易数量和融资金额分别占行业总和的36%和70%,其余赛道分布相对较为均匀。单看基因检测公司,肿瘤伴随诊断、肿瘤早筛早诊以及微生物新型检测是交易最为活跃的三个应用领域。
1. 肿瘤伴随诊断

该领域第一梯队和第二梯队的头部企业,在19年均完成了大额私募融资,且部分企业(燃石和泛生子),已经开始寻求公开市场的募资之路。预计这些头部企业完成上市后,会与竞品在资金上拉开更明显的差距,市场竞争格局也将进一步明朗。
我们认为,产品及销售的合规化、提高检测产品的人群渗透率以及赋能医院提升院端的检测能力等,仍然是行业未来发力的主要方向。不过,由于新产品研发、市场开发教育及临床试验都需要巨大投入,且临床端销售费用短期难以降到可控范围,因此行业的整体稳定盈利尚需一段时间。
目前部分企业开始探索如设计检测产品与保险的销售组合,为药企提供综合的药物研发销售服务等新模式。这些新商业模式能否为企业带来更多元化的收入,能否为行业发展注入新的动力,还需时间检验。
2. 肿瘤早筛早诊

2019年,康立明和诺辉健康分别完成了大额私募融资交易,在推进现有产品商业化的同时,也积极扩展多个单癌种早筛早诊的产品线。此外,基准医疗也与Illumina展开合作,携手开发肿瘤筛查、诊断和监测产品。
该领域的快速发展离不开国家的政策鼓励。2019年9月,国家卫健委等10部门,联合制定了《健康中国行动——癌症防治实施方案(2019—2022年)》,明确加快推进癌症的早期筛查和早诊早治,扩大癌症筛查和早诊早治的覆盖范围,引导高危人群定期接受防癌体检,提高癌症生存率。
肿瘤早筛早诊领域前景广阔,但目前还处于早期阶段,发展成熟需要时间。不仅需要通过新技术手段进一步提升产品的检测性能指标,而且必须将产品投入严格的临床验证试验,以确保安全有效。产品的合规报证是必经之路,也是这个领域长期健康发展的关键。
3. 新型微生物检测

多家使用新型分子检测手段(包括mNGS)做病原诊断的公司,包括行业龙头华大因源,皆在2019年下半年先后完成了私募融资。与此同时,一些主营基因检测其他领域的企业,也在19年建立了微生物检验的分公司或事业部。
感染是临床病人的主要死因之一,但目前临床检测手段还存在检出率准确性低、耗时长、缺乏对未知病原发现能力等亟待解决的问题。尤其新冠病毒疫情出现后,使得人们对临床微生物检验新技术的需求更加强烈,与此同时也给予了新型微生物检测企业展现实力的机会。在这次疫情中,我们惊喜的发现部分企业成为了首批在患者中发现病毒核酸序列的机构,为疫情后续防控工作提供了有力的技术支持。
综合来看,行业的前景良好,适用人群、场景延展以及产品合规标准化,让市场有进一步扩展的空间。
4. 第三方检验

药明奥测完成了A轮5000万美元的融资。该企业专注于高端特检项目,建立多平台、多组学及临床大数据整合平台,赋能辅助诊疗决策和临床研究。
DRG在全国范围的实施,将对第三方检测领域的企业业务发展起到积极作用,实施DRG地区医院检验外包的比例将获得显著提升。
此外随着政策对第三方检验机构核酸检测资质的进一步放开,企业特检业务比例及整体利润率有望相应得到提升。
5. 数字PCR和单细胞

这两个领域所使用的技术有一定相互借鉴的意义。随着微液滴、微流控技术平台的成熟,相关应用领域的企业开始不断涌现。2019年,包括新格元、百奥智汇在内的多家企业完成了融资扩张。
这些企业还处于发展早期,仍在探索技术平台和应用场景。但有海外的BioRad和10x Genomics等公司珠玉在前,该领域发展前景可期。
6. 质谱

质谱被认为是诊断行业的下一个“基因测序”,具有很大市场空间的平台型技术。随着技术的成熟,逐渐由科研走向临床,市场拓展在即。2019年有包括融智生物、英盛生物、佰辰诊断、百趣生物在内的多家公司完成了融资,其中融智和英盛的融资均接近亿元。
上游仪器寡头垄断,绝大部分依赖进口,多数国内企业通过OEM开发试剂盒或采购质谱仪,以服务模式拓展业务。融智生物率先完成上游布局,自主研发的宽谱定量飞行时间质谱QuanTOF和微流控芯片核酸快速分析QuanPLEX应用范围广泛,可用于微生物的快速鉴定、SNP基因分型、蛋白定量等分析。
美国临床质谱检测占医学检测市场的15%,而中国只有1-2%,潜力巨大。目前国内质谱相对成熟的临床应用主要集中在微生物鉴定和新生儿遗传疾病的筛查,维生素、血药浓度监测和小分子标志物还处于发展早期,将有可能成为未来中国临床质谱炙手可热的领域。

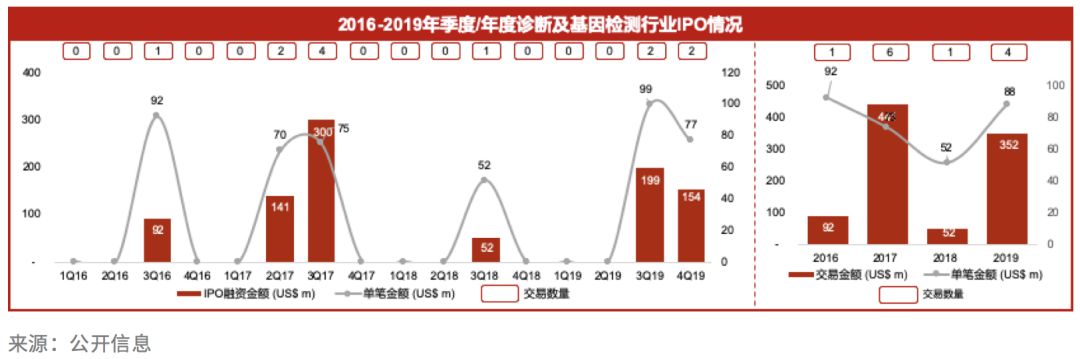

科创板开板半年以来,共有16家医药生物企业敲锣开市,其中IVD的3家企业分别是热景生物、普门科技和硕世生物,平均募资额达5.2亿人民币, 成为了生物医药板块最为热门的细分领域之一。
登陆科创板的IVD上市公司至今平均涨幅近102.97%,中位涨幅99.25%(跑赢科创板指数3.8%的涨幅)。IVD企业平均市盈率为87.42,在主要板块中位列第三。上市企业产品主要涉及心脑血管疾病、炎症感染、病原、女性生殖、癌症早筛等领域。这些公司未来营收增长的主要动力来自国产产品的进口替代和分级诊疗带来的基层市场扩容。
此外,东方基因、圣湘生物2家企业提交了上市申请,其中东方基因已于2020年2月初正式挂牌交易。
整体而言,科创板对IVD企业的偏好集中在POCT、化学发光、PCR分子诊断等领域,申报企业特征为平均收入超过2亿元以上、净利超过4000万元以上的规模型企业。科创板开锣初期,医疗健康板块申报企业以盈利的医疗器械企业为主,其中IVD企业优先受益,占比接近25%,科创板给未上市IVD企业提供了更便捷高效的IPO路径和更高的市场估值。

2019年,华检医疗也成功登陆香港交易所,募集总金额达10亿港元。华检医疗作为体外诊断产品的流通商,专注于为各医疗机构供应商和分销商提供IVD仪器、试剂、耗材,以及临床实验室集中采购的解决方案。

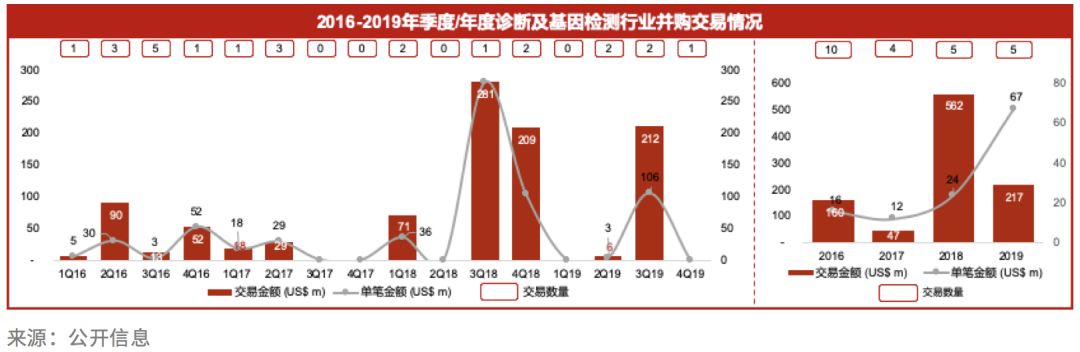
过去一年,诊断行业发生了两笔超过10亿人民币的重大并购交易。杭州下城国投以15亿人民币获得润达医疗20.02%的股份,成为控股股东。除了帮助公司拓展融资渠道,缓解公司资金压力之外,国资战略投资人的加入也有助于公司开拓公立医院渠道,保证公司业务持续快速发展。
另一起并购交易,是九强生物与国药投资共同收购了迈新生物,通过此次并购,九强的诊断业务线将延展到病理诊断试剂和仪器领域。九强也借助本次与国药的联合收购,达成双方更紧密的战略绑定,借助国药的广阔渠道更好地覆盖全国。

2019年海外融资交易超过半数由基因检测相关企业完成,并出现了多笔交易额超出3000万美元以上的大额交易。分子诊断公司热度持续,占据了绝大部分的行业资源,体现出海外市场对分子诊断领域的持续关注。

1.测序仪器

海外基因测序仪在2019年仍旧受到高度关注,但几家行业先行者却境遇不同。
2019年不算是Illumina的大年。Illumina虽然与Qiagen达成深度产品合作,使后者彻底退出了测序仪的竞争,但全年Illumina都未发布新仪器。加上芯片业务下滑、国家级基因组项目启动延迟,导致Illumina全球业绩放缓,让市场对公司的热情有所降低。
此外,Illumina收购PacBio的提案,也在过去一年中遭遇重重阻力:先后受到了来自英美两国监管机构的质询以及竞争对手Oxford Nanopore的强烈反对。尽管Illumina曾提议用免费开发部分PacBio测序专利作为交换来推进收购,但依然未能达成交易。最终,Illumina以9800万美元的分手费终止了收购。
ThermoFisher在2019年推出了主打易用性的全新测序系统。虽然在通量指标上仍逊色于竞争对手,但该系统在“样品-结果”工作流程自动化上下了功夫,针对缺乏专业操作人员和场地的基层医疗机构,推出了中小型Panel检测。
在单分子长读长仪器领域,PacBio和Oxford Nanopore(ONT)对现有机型进行了升级,提高了数据产出量,降低了使用成本,并且扩展了使用场景。ONT在2019年成功完成了约1.4亿美元的新一轮融资。在基因组结构变异检出上继续提升表现之外,ONT还将应用拓展到临床感染性疾病病原检测、食品安全以及部分PCR和NGS难以检出的遗传病等领域。同时,借助仪器的小型便携以及操作简单化的优势,ONT继续向POCT以及微生物现场检测方向发力,与短读长测序平台做差异化竞争。此外,与华大联手赢得阿联酋人群测序项目,也为ONT未来竞标国家级人群队列测序项目添加重磅砝码。
业内其他公司,在私募融资取得重大进展的同时,也在产品研发上推陈出新,力图打破测序仪市场一家独大的局面。新型测序仪公司Genapsys宣布完成C轮9000万美元融资,并在美国发售了基于微流控和CMOS芯片检测技术的小型中低通量测序仪产品,主打低成本测序仪市场,目标用户为中小型实验室。两家使用全新DNA测序技术平台的公司——Omniome和Element Biosciences,均获得了来自一流风投基金的大额私募融资。有趣的是,这两家公司的创始团队成员都与Illumina有些许渊源,尽管双方目前尚未有测序样机面世,但两家公司均将提高产品易用性、数据产出以及降低成本作为研发目标。
2.早诊早筛

早诊早筛是2019年海外基因检测领域的又一大热点。过去一年有多家公司完成了大额私募融资,除了“老兵”Grail完成了1.25亿美元的融资之外,新锐公司如Thrive,Freenome和Seer Bio也在2019年分别完成了1.1亿美元、1.6亿美元和7250万美元(C轮1750万,D轮5500万)的融资。
从技术路线上分析,早筛技术路线更加呈现多元化的趋势。在总体成本可控的基础上,为了提高检测的指标,各家公司更倾向于采用多种标志物联合检测(DNA变异、甲基化、片段组、血浆蛋白标志物等)。检测方法学也从以基因检测为主导,转变为基因+蛋白技术路线(例如,Thrive和Freenome),用多靶标检测提高早期肿瘤的检出率。值得一提的是,Seer Bio采用了与竞品完全不同的路线,突破性地使用新型质谱技术,依靠血浆蛋白标志物检测血液中的早期肿瘤信号。
Oncimmune独树一帜,采用检测多种自身抗体组合的方法来进行肿瘤早筛。在已公布的肺癌筛查临床试验EarlyCDT-Lung中,随机接受EarlyCDT检测的患者在随访期内,发现早期肺癌的比例更高。
作为行业的超级独角兽Grail来说,2019年是它们试图摆脱公司发展前期烧钱太快、管理层动荡以及临床产品进展缓慢等负面新闻,打翻身仗的一年。Grail的多癌种液体活检产品可以高度特异地在12种肿瘤患者血液中检测出肿瘤信号,斩获FDA的突破性医疗器械认定,紧接着公司发表了该产品在20个瘤种中独立验证试验的良好结果。Grail在去年年底成功完成融资,目前正以积极势头继续推动各项临床试验。
一些较早进入资本市场的头部肿瘤基因检测企业,也积极投身肿瘤早筛的大潮。依靠液体活检进入肿瘤伴随诊断市场的Guardant Health在早筛领域密集投入资源,于19年初收购了Bellwether Bio,将Bellwether的cfDNA片段组分析技术结合到了已有的ctDNA检测技术平台,形成了DNA变异+表观遗传(DNA甲基化+片段组)早筛检测技术组合。在名为LUNAR-2的肠癌临床验证试验中,Guardant的肠癌早筛技术展现出良好的检测指标。公司随即于19年中,启动了名为ECLIPSE的大规模前瞻性肠癌筛查临床试验,计划入组10000名肠癌平均风险志愿者,通过检测并追踪这些患者,来评估公司肠癌早筛产品的临床表现。
Guardant主推的伴随诊断业务也进展颇丰,继前瞻性肺癌NILE临床试验,支持在肺癌伴随诊断中将ctDNA检测推向一线诊断后,主打产品Guardant360也在诊断大多数实体瘤领域获得了美国国家医保的覆盖。
以肠癌早筛起家的Exact Sciences,其拳头产品Cologuard在销售上继续高歌猛进,收获了45-49岁扩展适应人群。公司在去年开启了并购和投资扩张的模式:以总额28亿美元收购了肿瘤基因检测公司Genomic Health。除获得Genomic Health的在售产品线(主为乳腺癌辅助治疗产品)之外,还借机提高样本检测能力并扩充了产品注册报批和销售团队,为公司接下来推进早筛新品的报证和商业化打好更坚实的基础。
Exact Sciences参投了新锐早筛公司Thrive Earlier Detection,布局新早筛检测方法学。在临床进展方面,Cologuard的升级版推进顺利,公司在肝癌早筛领域也取得了积极进展。早期肝癌的筛查产品,将DNA甲基化标志物与血浆蛋白检测相结合,展现了优于传统甲胎蛋白检测的性能,并因此获得了FDA授予的突破性医疗器械认定。
3. 大规模人群队列测序

2019年大规模人群队列测序项目也出现了新的突破。英国生物样本库UKBioBank与Wellcome Trust慈善基金联合4家药企(Amgen, AstraZeneca,GSK和JnJ)达成战略合作:将共同出资2亿英镑,对UK BioBank中50万名参与者的样本进行全基因组测序,来为阿兹海默症和肿瘤等疾病寻找预防、诊断和治疗手段。UK BioBank收集了来自志愿者的血液、尿样、唾液样本以及完整的电子健康信息。这些表型和基因型信息将对世界范围开放,为遗传学、医学、公共卫生研究以及新药开发等领域,提供医疗大数据的强大支持。
4. 单细胞测序

单细胞测序领域的企业在2019年取得了不少新进展。私募融资方面,单细胞蛋白质组学公司Isoplexis获得了近5000万美元的资金,用以加速其单细胞免疫标志物检测平台,在肿瘤及其他疾病新疗法发现上的应用。
10x Genomics无疑是领域内的翘楚,在1月完成3500万美元的D轮融资之后,于8月登陆NASDAQ并募集了3.9亿美元,市值一度突破100亿美元。随后公司于年底发布了全新空间基因表达检测产品,将单细胞研究工具推到新高度。
单细胞测序的应用场景也在不断拓展,专注于单细胞组学分析指导新药开发的公司Celsius Therapeutics与Janssen达成了合作,将帮助Janssen寻找预测炎性肠病治疗效果的生物标志物。
5. 消费级基因组检测

2019年,海外消费级基因组检测(DTC)公司都经受了比较大的挑战。23andMe、Ancestry和Helix均宣布了裁员计划;Veritas也因资金原因终止了所有美国业务。DTC检测使用试剂耗材(如基因芯片)总量的下降,也直接拖累了Illumina的营收。
市场整体下调有3个潜在原因:
1)市场饱和:全美已经有2-3千万人接受了DTC检测,对DTC好奇的早期客户在美国已经趋近饱和;
2)作用有限:检测报告的祖源信息对于用户的意义不大,目前单个基因变异信息对用户健康医疗的指导意义还不成熟;
3)隐私安全风险:美国执法机构调用DTC检测用户的基因信息辅助抓捕嫌犯,使大众对基因隐私安全提高了警觉。
未来海外DTC领域的发展,需要转换服务对象并提升产品内容:
1)从消费向医疗转化:包括将风险基因检测项目注册报批、为人群队列的健康研究提供基因型检测、与药厂密切合作探寻新的靶点和药物作用机制;
2)提供解决方案:除提供检测报告,可以后续为患者提供针对性的产品和服务,形成检测-产品/服务的闭环;
3)强化健康管理信息:如将多基因风险评分分析算法(Polygenic RiskScore)及微生物组引入DTC检测,为用户提供丰富且长期健康信息。
6. 新型检测技术

新型检测技术领域中,AdaptiveBiotechnologies也2019年登陆NASDAQ,募集了3亿美元的资金。公司采用高通量测序方法分析T细胞和B细胞受体序列。旗下的急性淋巴细胞白血病MRD检测产品已经获批上市,敏感度远超现有的检测技术。公司也与微软开展合作,通过对血液中免疫细胞的测序分析,结合机器学习来了解免疫系统与多种疾病之间的关系。
Mammoth Biosciences和Sherlock Biosciences是CRISPR-Cas基因编辑系统的疾病诊断平台中最具代表性的两家公司,由基因编辑领域的两大阵营:Jennifer Doudna和张锋于2017年和2019年分别成立。Sherlock成立之初就获得了3500万美元的A轮融资,Mammoth也于最近锁定了4500万美元的B轮融资。CRISPR核酸快诊方法是两家产品开发的重心。在本次新冠疫情中,Sherlock也公布了对应的病毒RNA快速检测方案,大大缩短了样本处理和分析流程。
生殖遗传领域Cradle Genomics的出现,让大家对NIPT的进一步发展再度燃起热情。利用宫颈处收集的滋养层细胞进行无创胎儿基因检测的方法,有希望在孕产更早期,以更低的成本实现更全面的基因相关疾病检测。
ArcherDx致力于锚定多重PCR(AMP)建库技术检测基因融合与突变。公司在2019年完成了2轮共计1.15亿美元的融资。ArcherDx独有的PCR建库技术,可以在检出新融合基因的同时完成突变的检测。随后公司与Illumina在IVD产品开发方面达成合作。
7. 其他值得关注的产品注册进展

NantHealth的肿瘤全外显子组测序(WES)产品获得FDA批准。获批基于与FDA已批准的MSK-IMPACT468基因Panel进行突变检测一致性验证的结果。除报告这468个基因的体细胞突变之外(突变频率可低至2%),该产品还可以检测癌症组织中的肿瘤突变负荷(TMB)。这是FDA批准的首个检测实体瘤肿瘤突变负荷(TMB)的WES诊断产品。
TMB曾被认为是预测免疫检查点抑制剂疗效的重要标志物,然而在2019年的多项临床试验中,TMB的预测价值却屡遭挑战。在BMS和MSD进行的数个临床试验中,无论TMB水平高低,免疫联合疗法(免疫+免疫或免疫+化疗)的效果都非常类似。导致阴性结果的原因,可能源于联合疗法本身,也可能因TMB的检测方法尚未标准化。因此,基于WES的TMB检测产品虽然获批,但是其能否在临床端有实际应用价值,还有待进一步临床试验的证实。
Vela Diagnostics开发的基于NGS的HIV-1耐药突变检测产品,在2019年获得FDA批准上市。这款经由FDA De Novo审批路径进行申报的检测试剂盒,是首个采用NGS方法学对HIV进行基因分型与耐药检测的创新性产品。
Bio-Techne旗下的外泌体前列腺癌诊断产品,获得了FDA突破性医疗器械认定,成为首个获得该项认定的外泌体液体活检产品,并被NCCN前列腺癌诊疗指南所推荐。
LAM的肝癌早期筛查产品获得了FDA突破性医疗器械认定。该款产品基于ctDNA的甲基化信号对早期肝癌进行无创检测,可达较高的准确度。
Prescient Metabiomics的肠癌筛查产品LifeKit Prevent获得FDA突破性医疗器械认定。与目前市场上粪便DNA肠癌筛查类产品不同的是,该项产品是通过检测粪便微生物中的DNA和RNA标志物,而非人源DNA来检测腺瘤以及早期肠癌。
原文链接:https://news.pedaily.cn/202003/453126.shtml