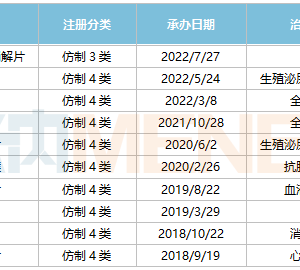
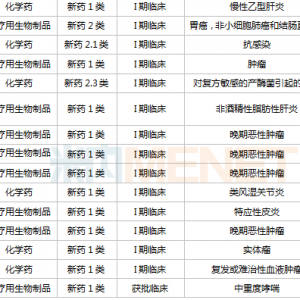
1月26日,国家药监局药审中心发布《嵌合抗原受体T细胞(CAR-T)治疗产品申报上市临床风险管理计划技术指导原则》(以下称《指导原则》),《指导原则》从CAR-T治疗产品的概述、安全性、药物警戒、风险最小化措施等方面对CAR-T治疗产品展开了详细的描述。
就CAR-T细胞治疗产品可能存在的安全性风险,《指导原则》根据CAR-T产品从生产、运输、处理、给药、随访等流程的时间顺序,详细列举了CAR-T细胞治疗产品可能存在的安全性风险。本文将通过梳理《指导原则》中列举的CAR-T疗法安全性风险,详述在CAR-T产品的运用中可能面临的风险。
01
CAR-T细胞疗法存在的安全性风险
CAR-T疗法存在六大风险,包括与产品的质量特征、储存和分配相关的对患者造成的风险、与产品作用相关的风险、与患者基础疾病或与合并使用其他药物的相互作用相关的风险、与给药程序和给药方式有关的对患者造成的风险、与患者不良事件处理相关的风险和其他尚未排除的风险。其中,前三大风险是CAR-T疗法的主要风险。
(1)与产品的质量特征、储存和分配相关的对患者造成的风险。这类风险包括疾病传播的风险、致瘤性的风险及与产品的制备、储存、运输和分配有关的风险。例如T细胞的来源,即自体或者异体导致的疾病传播风险;或者使用基因编辑技术对基因组产生非目的的靶向,进而导致患者肿瘤风险的增加;此外,CAR-T产品保存、冷冻和解冻过程中与产品稳定性有关的风险亦可能影响CAR-T细胞的生物学活性。
(2)与产品作用相关的风险。这类风险包括T细胞激活引起的CRS、ICANS、其他神经毒性等,CAR-T细胞攻击表达靶抗原的正常组织细胞,从而引起的正常组织损伤或免疫缺陷;长期安全性风险,如持续低丙种球蛋白血症或无丙种球蛋白血症导致的感染风险、恶性肿瘤和自身免疫性疾病等。
(3)与患者基础疾病或与合并使用其他药物的相互作用相关的风险:这类风险包括与患者自身情况如肿瘤负荷、合并移植物抗宿主病等相关的风险;与预处理相关的风险,如淋巴细胞清除术用化疗药物或处理并发症时使用免疫抑制剂等;对患者或供者细胞进行预期和非预期基因修饰有关的风险,如细胞凋亡、功能改变、恶性肿瘤。
02
盘点我国两款上市CAR-T细胞产品
2021年可谓我国CAR-T细胞疗法的元年,两款CAR-T细胞疗法相继获批上市,分别是复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛注射液。从靶点的角度,两款产品均靶向CD19,为晚期B细胞淋巴瘤患者提供了新的治疗手段;从疗效的角度,两款产品治疗DLBCL均实现了超过70%的客观缓解率,疗效十分卓越;从安全性的角度,两款产品均是自体CAR-T细胞疗法,不存在移植物抗宿主病(GvHD),但均存在较高水平的细胞因子释放综合征(CRS)和神经毒性(ICANS)。
(1)阿基仑赛注射液是复星凯特2017年初从美国Kite(吉利德旗下公司)引进Yescarta (axicabtagene ciloleucel) 在中国进行技术转移,并获授权在中国进行本地化生产的靶向人CD19自体CAR-T细胞治疗产品。2021年6月在中国批准上市,用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,是中国首个获批上市的细胞治疗类产品。阿基仑赛注射液售价高达120万元,目前尚未纳入国家医保目录。
阿基仑赛注射液DLBCL适应症的获批基于关键性临床研究ZUMA-1的积极数据,一年随访结果显示:最佳总缓解率(ORR)为82%,完全缓解率(CR)达到了54%;中位随访27.1个月,客观缓解率、完全缓解率和持续缓解率分别为83%、58%和39%;随访≥4年(中位数,51.1个月),中位总生存期为25.8个月,4年总生存率达44%。
安全性方面,研究中13%的患者经历了3级或更高级别的细胞因子释放综合征(CRS),31%的患者经历了神经系统毒性。常见的(≥10%)3级或更高级别反应包括:发热性中性粒细胞减少、发烧、CRS、脑病、病原菌不明感染、低血压、低氧血症、肺部感染。严重不良反应发生于52%的患者,包括:CRS、神经毒性、延长的血细胞减少(包括中性粒细胞减少、血细胞减少、贫血)和严重感染。该研究中发生了CRS和神经毒性致死病例。
(2)瑞基奥仑赛注射液是在美国 Juno 公司 JCAR017 基础上,由药明巨诺自主开发的一款靶向CD19的CAR-T细胞疗法。2021年9月,NMPA批准了瑞基奥仑赛注射液用于治疗经过二线或以上全身性治疗后成人患者的复发或难治性大B细胞淋巴瘤。瑞基奥仑赛注射液目前售价为129万元,尚未纳入国家医保目录。
瑞基奥仑赛注射液DLBCL适应症的获批基于关键性临床研究RELIANCE数据,试验结果表明,在58例可评估有效性的患者中,最佳客观缓解率为75.9%,最佳完全缓解率为51.7%。中位随访时间8.9个月,未达到中位OS,6个月DOR、PFS和OS率分别为60.0%、54.2%和90.8%。
安全性方面,28位患者(47.5%)出现了不同等级的细胞因子释放综合征(CRS)。分别有2位患者(3.4%)与1位患者(1.7%)出现了3级与4级CRS,12位患者出现了神经毒性,其中仅有3位患者(5.1%)出现严重(均为3级)。
图:RELIANCE试验设计
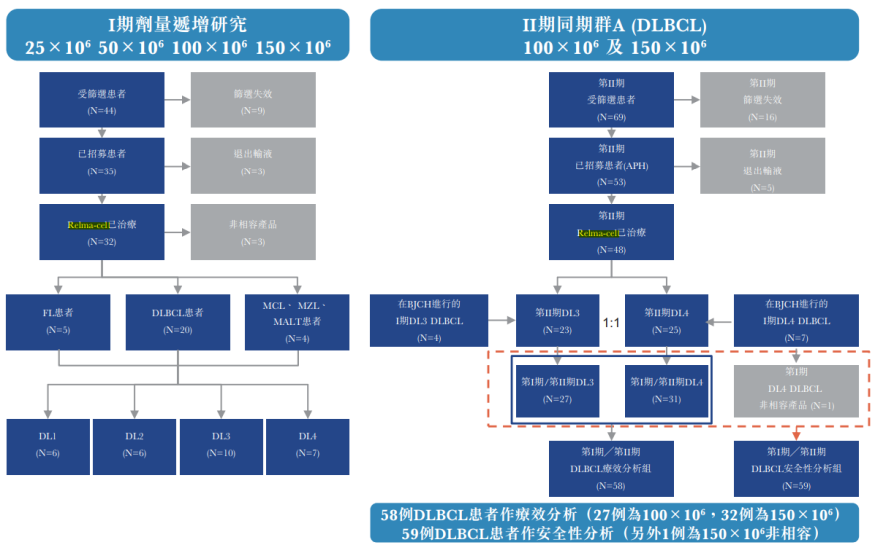
数据来源:药明巨诺
03
CAR-T细胞产品未来何去何从
尽管CAR-T细胞疗法针对晚期血液肿瘤实现了极佳的客观缓解率,但安全性风险始终如同一把悬在头上的达摩克里斯之剑,三级以上的CRS及ICANS的频频发生使医生在使用CAR-T疗法时如履薄冰。
传奇生物曾一度探索门诊给药的便利性,希望能降低CAR-T细胞疗法的整体高昂费用,但门诊给药的风险却又令企业十分担心,因此门诊给药在临床中仅纳入了一名患者。
针对轻度CRS,临床常通过支持性护理、退热治疗,并进行抗生素治疗以避免感染。而重度CRS则可采用皮质类固醇、托珠单抗(IL-6)及抗IL1治疗。神经毒性(ICANS)可运用抗癫痫药物处理,针对感染并发症常规使用抗菌药物治疗,以防止中性粒细胞的减少。
而针对从源头上降低包括CRS等风险的思路,CAR-NK或许是CAR-T细胞疗法的下一城。CAR-NK不分泌IL-6,仅分泌少量IFN–γ和GM-CSF等细胞因子,因此不易诱发严重细胞因子风暴。
根据目前披露的一些临床数据,如Fate Therapeutics靶向PD-1的CAR-NK候选产品FT500,未发生CRS、ICANS或GvHD,安全性十分良好。公司旗下另一款靶向CD19的CAR-NK候选产品FT596,根据公司在2020ASH上披露的数据,亦未发生任何级别的CRS、ICANS或GvHD。当然,CAR-NK目前数据尚十分有限,未来仍需更多临床数据披露以进一步观察。
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。
本网页由机器采集生成,若侵权请及时联系删除。
原文链接:https://med.sina.com/article_detail_103_2_112302.html