肠道神经系统受中枢神经系统的控制,且富含神经元。肠道神经系统中的神经元也可以分泌许多神经递质,如5-羟色胺和乙酰胆碱(Ach)。而小肠上皮细胞可以表达Ach受体:毒蕈碱受体和烟碱受体。作为G蛋白偶联受体(G-proteincoupledreceptors,GPCRs),毒蕈碱受体通过下游的信号通路影响基因表达和细胞的功能。但是小肠上皮细胞表达胆碱受体的重要性和小肠上皮细胞与神经系统是否发生直接作用还不清楚。
而发表在《Immunity》这篇文章中,作者发现在秀丽隐杆线虫的小肠上皮细胞中,毒蕈碱信号通路可以通过激活Wnt信号通路控制先天性防御的基因表达,将神经细胞的信号通路和肠道的先天免疫作用联系了起来[1]。
金黄色葡萄球菌感染线虫会导致小肠上皮细胞中的clec-60明显升高。clec-60基因编码一个分泌蛋白,具有抗菌的作用。根据已有文献,作者猜测感染导致的clec-60表达升高可能通过GPCRs信号通路进行[2]。为了检测clec-60上游的信号通路,作者在金黄色葡萄球菌感染的线虫中利用RNAi的方式干扰了890个GPCRs基因的表达。结果发现,毒蕈碱受体编码基因gar-2的表达被RNAi干扰后,clec-60的表达也受到了抑制。秀丽隐杆线虫有两个编码毒蕈碱受体的基因,gar-2和gar-3。进一步的实验发现,gar-2和gar-3在介导感染导致的clec-60升高中均有作用。
作者又利用了Ach的拟似物Arecoline,发现可以达到与金黄色葡萄球菌感染相类似的效果,成功诱导clec-60等感染相关基因的表达。而利用毒蕈碱受体的拮抗剂Scopolamine则起到了相反的作用。毒蕈碱受体的激动Oxotremorine也可以诱导clec-60的表达。综合以上实验结果,线虫通过毒蕈碱受体的激活抵御金黄色葡萄球菌的感染(图1)。
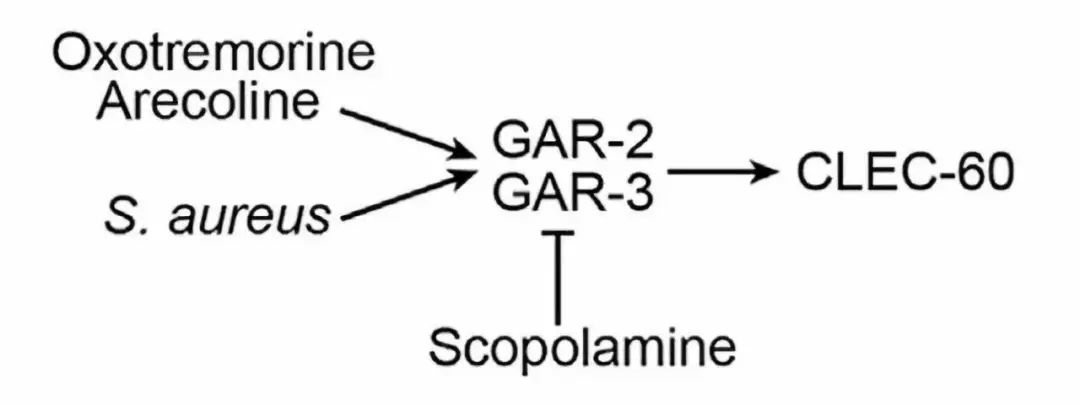
图1.线虫通过激活毒蕈碱受体抵御感染示意图
已有文献报道,金黄色葡萄球菌感染导致线虫的clec-60表达升高依赖于β-catenin的等位基因bar-1,bar-1在经典的Wnt信号通路的发挥作用。作者发现,细菌感染会导致线虫高表达Wnt信号配体基因cwn-2。而在未被细菌感染的线虫内,利用胆碱受体的拟似物Arecoline和激动剂Oxotremorine也可以刺激cwn-2的表达(图2)。
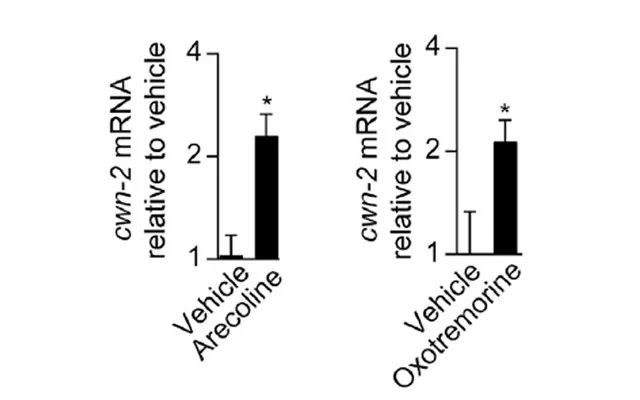
图2.胆碱受体激动剂刺激Wnt信号通路配体的表达
此外,作者还发现,在细菌感染后线虫体内的Ach快速升高,在10min内即达到峰值,随后开始逐渐减低,并在4h以后稳定在一定水平。而cwn-2和clec-60的mRNA表达水平则是在感染后逐渐升高,并在16h左右才达到峰值。综合以上结果,金黄色葡萄球菌的感染刺激Ach释放激活毒蕈碱信号通路,而毒蕈碱信号通路的又诱导Wnt信号通路的受体和配体的表达(图3)。

图3.细菌感染后毒蕈碱信号通路和Wnt信号通路的联系
为了进一步研究Wnt信号通路对于抗感染的作用,作者敲除了Wnt信号通路受体Frizzled的编码基因mig-1,与野生型相比毒蕈碱信号通路的抗菌作用被明显破坏。证明毒蕈碱信号通路的抗菌作用下游需要通过Wnt信号通路,而Wnt信号通路在先天性免疫反应中也是必要的条件(图4)。
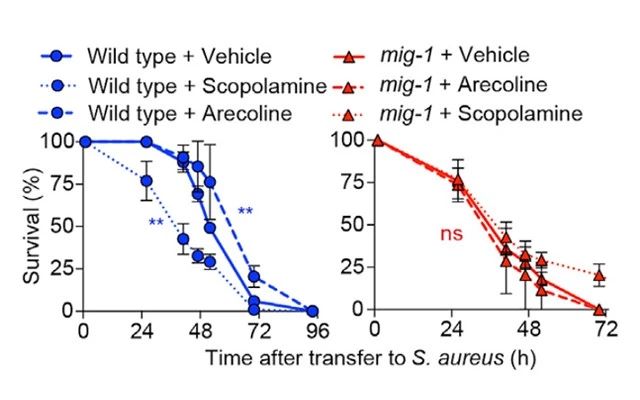
图4.Wnt信号通路在毒蕈碱信号通路的必要性
小M的小思考:
毒蕈碱信号通路是神经细胞胆碱受体的重要信号通路,Wnt信号通路在生物体内是高度保守的信号通路,可以调节小肠上皮细胞的分化等众多生物学过程。本篇文章将神经细胞的信号通路和肠道系统的先天性防御作用联系起来,进一步揭示了肠脑轴在肠道系统、免疫系统和神经系统中交互调控的复杂性和重要性。此外,在本篇文章的研究过程中多个小分子化合物(毒蕈碱信号通路和Wnt信号通路的激动剂、抑制剂)的应用也提示我们,抗毒蕈碱的化合物可以作为炎症疾病的药物,进一步接受临床试验的检验。
参考文献
[1] Labed SA,et al., IntestinalEpithelialWntSignalingMediatesAcetylcholine-TriggeredHostDefenseagainstInfection.Immunity.2018 May 15;48(5):963-978.e4.
[2] Styer, K.L.et al., Innate immunity in Caenorhabditis elegansis regulated by neurons expressing NPR-1/GPCR. Science.2008; 322, 460–464.
本网页由机器采集生成,若侵权请及时联系删除。
原文链接:https://med.sina.com/article_detail_103_2_114057.html